螯合作用查看源代码讨论查看历史
螯合作用(Chelation)指化学反应中金属离子以配位键与同一分子中的两个或更多的配位原子(非金属)连结而形成含有金属离子的杂环结构(螯环)的一种作用。类似蟹钳的螯合作用,故名。螯环的形成使螯合物比组成和结构相近的非螯合络合物具有更大的稳定性,这种由螯合作用引起的增加稳定性的效应称为螯合效应。例如,乙二胺与金属离子的螯合物就比氨的金属络合物稳定得多,而二乙基三胺的金属螯合物因同时形成两个螯环则更为稳定。[1]
 |
分类
络合物包括的范围很广,品种繁多,但按其结构形式主要可分作几类:
(1)简单配位化合物。这一类是由单基配位体与中心离子简单配位形成的络合物如FeCl3等。这些络离子在溶液中能逐级解离生成一系列配位数不同的络离子。
(2)多核络合物。如果一个配位体中一个或两个配位原子同时同两个中心离子络合,从而使络合物内界含有两个或两个以上的中心离子,这样的络合物称为多核络合物。
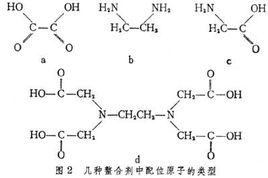
(3)螯合物。由中心离子和多基配位体络合生成具有环状结构的络合物称为螯合物。如二乙二胺合铜络离子。
根据现代科学实验现已确认在水溶液中大多数金属离子都能同水分子或其它离子(包括无机的和有机)的生成各种类型的络合离子,只有少数几种碱金属盐如卤化物、硝酸盐和氯酸盐在稀溶液情况下才是呈简单自由离子。由此可见,水溶液中溶质络合物形态的现象十分普遍。
定义
同一配体中两个或两个以上配位原子与同一个中心原子间的配位成环过程。
特点
螯合作用是指金属等中心元素能形成螯合物的过程。人体内所摄取的无机铁之中,实际上被吸收的只有2-10%而已,将矿物质变成可被消化的形态时,通常都加上氨基酸,使它变成“螯状”的化合物。由中心离子和某些合乎一定条件同一多齿配位体的两个或两个以上配位原子,键合而成具有环状结构的配合物的过程称为螯合作用。
简介
一分子或两分子的官能团与金属离子之间,通过配位作用生成环状构造的化学反应,称为螯合作用,亦称螯环化或环合作用。人体内所摄取的无机铁之中,实际上被吸收的只有2-10%而已,将矿物质变成可被消化的形态时,通常都加上氨基酸,使它变成“螯状”的化合物。首先,Chelation,意思是将矿物性物质处理成可消化的形态。普通的矿物质产品,如骨粉、白云石(dolomite)等,几乎都还未经“螯合”处理过。所以,在消化过程中,首先必须经过“螯合”处理。但是,大多数人体内自然地将矿物质形成“螯合”化合物(chelate compound)的过程并不能顺利进行。所以,矿物质补品几乎都不能发挥其效用。由此我们知道,人体所摄取的物质并不能完全发挥其功效。大多数人体内并不能将食物有效地消化吸收,在其所涉的无机铁之中,实际上被消化的只有2%-10%,有50%会排泄出体外,所以人体对已经“螯合”处理过的矿物质的消化吸收比没有处理的高3-10倍。即使多花一些钱,也是值得的。
络合作用
通常由一个“简单”的正离子和一定数目的中性分子或负离子以配位键结合起来的化学质点,称为缔合离子或络合分子。由络合离子或络合分子组成的化合物称为络合物(有时把综合离子也称络合物,二者无严格区别)。络合物的组成一般分为内界和外界两个部分。中心离子和配位体所组成的称为络合物的内界,在络合物化学式中一般用方括号表示内界方括号以外的部分为外界。例如 [Cu(NH4)4]SO4。中心离子是络合物的核心部分,它位于络离子中心,多是带正电荷的离子(绝大多数是金属离子)与中心离子络合的离子(或分子)称为配位体。配位体中提供自由电子对的原子称为配位原子,配位原子大都是非金属原子。在络合离子中与中心离子以配位键结合的配位原子的数目称为配位数。在一个配位体中含有配位原子的数目称为配位体基数。
参考文献
- ↑ 什么是螯合反应?具体的机理是什么搜狗问问