五氟化銻檢視原始碼討論檢視歷史
| 五氟化銻 |
 |
五氟化銻(化學式:SbF5,式量:216.75)無色油狀液體,危險化學品。熔點7℃,沸點149.5℃,密度2.99g/cm蒸汽壓1.33kPa(25℃)。溶於無水乙醇主要用於製取銻化合物。對人類眼睛、皮膚、粘膜和呼吸道有強烈的刺激作用。吸入可能由於喉、支氣管的痙攣、水腫、炎症,化學性肺炎、肺水腫而致死。另外,對於環境亦有一定危害。
簡介
一、健康危害
侵入途徑:吸入、食入、經皮吸收。
健康危害:中毒表現有燒灼感、咳嗽、喘息、喉炎、氣短、頭痛、噁心和嘔吐。
二、毒理學資料及環境行為
急性毒性:LC50270mg/m3(小鼠吸入)
危險特性:受熱或遇水分解放熱,放出有毒的腐蝕性煙氣。有腐蝕性。和很多化合物劇烈反應,常常釋放有毒的氟化氫,它幾乎與目前已知的所有化合物產生反應。
燃燒(分解)產物:氟化氫、氧化銻。
環境標準:
前蘇聯 車間空氣中有害物質的最高容許濃度 0.3mg/m3[Sb]。
評價
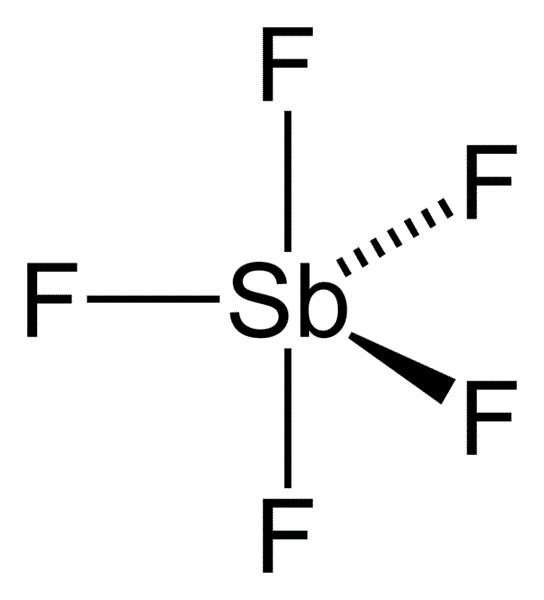
五氟化銻是已知除七氟化金(AuF5.F2)之外最強的路易斯酸,六氟合銻酸(寫作HSbF6或者HF.SbF5)是已知最強的超強酸, ,在氣態時,SbF5 採取 D3h 對稱群,為三角雙錐構型(如圖)。在液態和固態時結構更為複雜。液態時含有聚合物,且每個 Sb 都是八面體,其通式為 [SbF4(μ-F)2]n。在晶態時為四聚體,即化學式為 [SbF4(μ-F)]4。在四聚體的八元 Sb4F4 環中的 Sb-F鍵長為 2.02 Å;對於其他與四個Sb相連的 F− 配體,其 Sb-F 鍵較短為 1.82 Å。[2] 同族的 PF5 和 AsF5 在液態和固態時都為單體,可能是因為中心原子的體積較小,限制了配位數的緣故。BiF5 為聚合態。[3]
SbF5 是很強的路易斯酸,對 F− 的親合力尤其顯著,生成很穩定的 [SbF6]− 陰離子。[SbF6]− 可繼續與五氟化銻反應生成 [Sb2F11]−。
因此五氟化銻可增強 HF 的布朗斯特酸性,也可加強 F2 的氧化性。如五氟化銻存在下,氟氣可將氧氣氧化成 O2+:[4]
SbF5 + F2 + O2 → [O2]+[SbF6]−
首次用化學方法製取氟氣也利用了五氟化銻的強路易斯酸性,過程為:
2 SbF5 + K2MnF6 → 2 KSbF6 + MnF3 + 0.5 F2
反應中的 K2MnF6 可通過 KMnO4、KF、HF 和 H2O2 反應製取。SbF5 對 F− 的強親合力即 MnF4 的不穩定性使得製取氟氣的反應可以發生,機理類似於"強酸制弱酸",只不過酸為路易斯酸而已。[1]