生物成像檢視原始碼討論檢視歷史
| 生物成像 |
 |
生物成像是了解生物體組織結構,闡明生物體各種生理功能的一種重要研究手段。它利用光學或電子顯微鏡直接獲得生物細胞和組織的微觀結構圖像,通過對所得圖像的分析來了解生物細胞的各種生理過程。近年來,隨着光學成像技術的發展,尤其是數字化成像技術和計算機圖像分析技術的引進,生物成像技術已經成為細胞生物學研究中不可或缺的方法。[1]
未來生物成像技術的發展除了進一步提高圖像的分辨率外,還需要增強成像的實時性和連續性,以期實現對單個生物功能分子的體內連續追蹤,詳細地記錄其生理過程,從而完全揭示其生物學功能。另外,生物成像技術在臨床醫學診斷中的應用也越來越受到重視,發展無損傷的體內成像技術是其在疾病診斷中廣泛應用的重要前提。
目錄
八種生物成像技術
引語
生物專欄:定期梳理生物領域發布過的好文章,總結一些專業知識,專業技能供大家參考。
材料人現在設立各種文章專欄,所涉及領域正在慢慢完善,由此也需要更多的專欄作者,期待你們的加入,有意向的小夥伴直接微信聯繫cailiaorenVIP。不要再猶豫,下一個專欄創始人就是你。請記住:縱然你離我千里萬里,我都在材料人等你!
前言
生物成像,顧名思義,是了解生物體組織結構,闡明生物體各種生理功能的一種重要研究手段。它利用光學或電子顯微鏡獲取生物細胞和組織的微觀結構圖像,用來了解生物細胞的各種生理過程。一般來說,生物成像僅僅是為了初步診斷,後續還需要利用各種治療方式來治癒相關疾病,這個過程也就是大家經常聽到的「診療一體化」。由於文章篇幅有限,這裡先介紹生物成像,下次再講後續生物治療手段。那麼目前生物成像方式有哪些呢?它們又各自有什麼優缺點呢?又有哪些材料已經廣泛應用於該成像模式?下面我們一起來看看。
熒光成像(Fluorescence imaging,FI)
2.1成像原理
FI的理論基礎是熒光物質被激發後所發射的熒光信號的強度在一定的範圍內與熒光素的量成線性關係。FI系統包括熒光信號激發系統(激發光源、光路傳輸組件)、熒光信號收集組件、信號檢測以及放大系統。
成像媒介:熒光
常用儀器:
熒光分光光度計——主要用於得到熒光激發和發射光譜,熒光壽命,量子產率等數據;
激光共聚焦顯微鏡——主要用於細胞熒光成像;
活體成像系統——主要用於動物體內熒光成像。
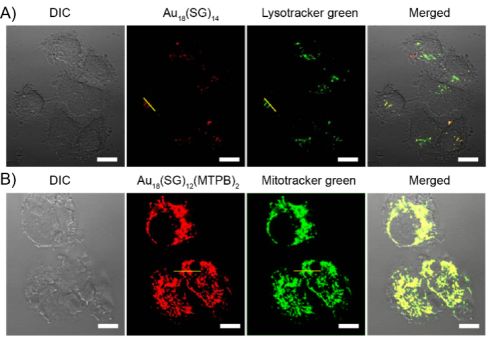
而這個發射的熒光信號的波長範圍一般在可見到紅外區域的居多。因為光的波長越長對組織的穿透力越強,所以對於能夠發射出波長較長的近紅外熒光(NIRF)的材料是我們所追求的。目前有很多熒光染料已經商業化,用於對細胞內部的各個細胞器進行染色,呈現出不同波長的發射光,從而有利於對單個生物功能分子的體內連續追蹤,詳細地記錄其生理過程。細胞熒光成像圖。
用100μg/ mL(A)Au18SG14和(B)Au18SG12MTPB2在37℃下與乳腺癌細胞共孵育1h後並分別與Lysotracker green和Mitotracker green共染色得到的共聚焦激光掃描顯微鏡圖像。在合併的圖片中,由紅色和綠色信號產生的黃色斑點表示納米糰簇在溶酶體或線粒體內的共定位情況。圖中所有比例尺均為20μm。[1]
2.2 優缺點
優點:成本較低,靈敏度高,可以做多色成像,操作較簡單。
缺點:空間分辨率較低,組織滲透性較差,一般只能做到表層。
2.3 經典造影劑
量子點[2],比如硅量子點,鍺量子點,CdS、CdSe、CdTe、ZnS、PbS、ZnSe量子點等等;
熒光染料[3],比如香豆素,熒光素,硼二吡咯甲基衍生物(BODIPY),羅丹明和花青染料(吲哚菁綠ICG,cy5等等);
鑭系元素摻雜的上轉換納米顆粒[4],比如NaYF4,Y2O3,Gd2O3,NaGdF4,GdF3,CaF2,LaPO4;
熒光金屬納米糰簇[5],比如穀胱甘肽或者牛血清白蛋白保護的金納米糰簇。
磁共振成像(Magnetic resonance imaging,MRI)
3.1成像原理
MRI是根據有磁距的原子核在磁場作用下,能產生能級間的躍遷的原理而採用的一項新檢查技術,利用外磁場和物體的相互作用來成像。MRI系統主要由三大基本構件組成,即磁體部分、磁共振波譜儀部分、數據處理和圖像重建部分。
成像媒介:磁場(無線電波)
常用儀器:磁共振掃描儀——用於體外模擬環境和活體成像
圖2 Fe3+螯合的黑色素納米粒子(MNP)的體外和體內MRI研究[6]。
(A)在瓊脂糖凝膠中不同濃度的Fe-RGD-PEG-MNP在磁場為1.0T,溫度25℃條件下得到的T1弛豫率(1/T1,s-1)。(B)Fe-RGD-PEG-MNP在活小鼠體內測得的MRI信號。用濃度為0,1.25,2.5(上層從左到右)和5,10,20(下層從左到右)μM的Fe-RGD-PEG-MNP對小鼠進行皮下注射(紅色虛線包圍的區域)。(C)對小鼠尾靜脈注射RGD-PEG-MNP 4 h後與0h比較得到U87MG腫瘤增強MR信號的定量分析。(D)對小鼠尾部靜脈注射250 μL,200 μM RGD-PEG-MNP前後所得到的U87MG腫瘤的MRI圖像(腫瘤部位被黃色虛線圈出)。頂行顯示黑白圖像,底行顯示偽彩色圖像。
3.2 優缺點
優點:空間分辨率高,不受組織穿透能力的限制;由於是磁場成像,無放射性,對人體無害。
缺點:花費成本較高,靈敏度較低,需要成像檢測時間較長,不能定量分析,T1、T2以及質子密度測量運算麻煩、可比性差。
3.3 經典造影劑
超順磁性造影劑:Fe3O4, MnFe2O4, FeCo
順磁納米粒子造影劑:Gd2O3, MnO
順磁性金屬離子和配體組成的造影劑:金屬離子主要為二價鐵Fe2+3d6,三價鐵Fe3+3d5,二價錳Mn2+3d5,三價釓Gd3+4f7鑭系元素,三價鏑Dy3+4f9鑭系元素,Gd3+有7個未成對電子,自旋磁矩大,電場對稱,弛豫效率高,易與水配位,且配位水分子為8-9個,是造影劑的較佳選擇。很多文獻都是優先採用Gd3+與各種配體(只要該配體富含負電子基團即可)螯合用於MRI分析[7-8]。
電子計算機斷層掃描(Computed tomography,CT)
4.1 成像原理
CT是用X射線束對人體某部一定厚度的層面進行掃描,由探測器接收透過該層面的X射線,轉變為可見光後,由光電轉換變為電信號,再經模擬/數字轉換器轉為數字,輸入計算機處理。CT圖像是層面圖像,常用的是橫斷面。為了顯示整個器官,需要多個連續的層面圖像。通過CT設備上圖像的重建程序的使用,還可重建冠狀面和矢狀面的層面圖像,可以多角度查看器官和病變的關係。CT系統主要由掃描部分(X線管、探測器和掃描架),計算機系統,圖像顯示和存儲系統三部分組成。
成像媒介:X線束
常用儀器:CT掃描儀——用於體外模擬環境和活體成像
圖3經過TAP-SiO2 @ AuNPs處理的血栓和非血栓形成模型的微型CT軸向切片,矢狀切片和血栓病變部位的3D重建圖像。黃色矩形表示小鼠原位血栓模型中形成的頸總動脈[9]。
4.2 優缺點
優點:空間分辨率較高,不受組織穿透力的限制
缺點:輻射風險大,不能定量分析
4.3 經典造影劑
已經用於臨床的(主要基於碘化化合物)
離子型造影劑: 泛影葡胺(Angiografin),複方泛影葡胺(Urografin)或泛影鈉(Hapaque);
非離子型造影劑:目前國內外均普遍建議使用非離子型造影劑,它與離子型造影劑相比具有毒性小,含碘高,副作用小和增強效果好等優點,但價格較昂貴。
碘普羅胺類:優維先(Ultravist)
碘海醇類:歐內派克(Omnipaque)
碘帕醇類:碘比樂(lopamiro)
目前處於研究階段的新一代CT造影劑:
金納米粒子[9],鉍(Bi),鐿(Yb)或金(Au)基納米顆粒[10-12],生物小分子保護的超小金納米糰簇[13]
發射型計算機斷層成像術(Emission Computed Tomography,ECT)
5.1 成像原理
ECT包括單光子發射計算機斷層成像術(Single-Photon Emission Computed Tomography,SPECT)和正電子發射斷層成像術(Positron Emission Tomography,PET)兩種,屬於核醫學的兩種CT技術。顧名思義,二者區別在於一個是單光子發射,一個是正電子發射。這便涉及到成像原理:SPECT成像所需要的放射性核素大多是衰變產生單一能量的γ光子即單光子,發射140KeV的低能γ光子;而PET成像所使用的是發射正電子的放射性核素,正電子是負電子的反物質,本身穿透性較弱,人體內正電子核素顯像所發射的正電子不能被體外的設備探測到,設備探測的是正電子與負電子相互作用後所產生的湮滅輻射過程的高能γ光子。
ECT系統的基本結構分3部分,即旋轉探頭裝置(專門探測γ射線)、電子線路、數據處理和圖像重建的計算機系統。
成像媒介:γ射線
常用儀器:ECT掃描儀
圖464Cu標記的黑色素納米粒子(MNP)的體外和體內PET研究。
(A)64Cu-RGD-PEG-MNP分別與經過和未經過RGD預處理的U87MG細胞在37℃下孵育1,2和4小時後所得的細胞攝取率。(B)在尾靜脈注射64Cu-RGD-PEG-MNP 2,4和24小時後獲得的經過衰變校正的冠狀(頂部)和橫軸(底部)小動物PET圖像(左三個圖像)和U87MG腫瘤的CT(灰色)和PET(彩色)(右三個圖像)的重疊圖像(黃色虛線圈出的區域)。(C)在尾靜脈注射64Cu-RGD-PEG-MNP 2,4和24小時後在小鼠體內的生物分布。使用在整個器官區域上繪製的感興趣區域計算來自每個器官的放射性信號[6]。
5.2 優缺點
SPECT
優點:靈敏度高,不受組織穿透力限制
缺點:有一定輻射風險,空間分辨率較低
PET
優點:靈敏度高,特異性高,可一次性全身掃描顯像,不受組織穿透力限制,可以定量分析。
缺點:有一定輻射風險(畢竟核素還是有一定放射性的,但所用劑量很少,遠遠小於常規CT檢查),花費成本高,空間分辨率較低。
5.3 典型造影劑
放射性核素:
SPECT常用99mTc、133I、67Ga、153Sm
PET常用18F、11C、13N、15O
6.光熱成像(Photothermal imaging,PTI)
6.1 成像原理
成像媒介:紅外輻射能量
常用儀器:紅外熱成像儀
紅外熱像儀主要由紅外探測器、光學成像物鏡、光機掃描系統三大部分構成。熱成像儀利用光學器件將場景中的物體發出的紅外能量聚焦在紅外探測器上,然後將每個探測器元件的紅外數據轉換成標準的圖片或者視頻格式,可以在標準的視頻監視器上顯示出來,或記錄在錄像帶上。
(A)用氙燈照射尾靜脈注射IABDP NPs後,體內含有HeLa腫瘤的裸鼠的PT圖像。(B)氙燈照射下的腫瘤溫度曲線[14]。
6.2 優缺點
優點:良好的溫度靈敏度,可實時監測
缺點:空間分辨率較差
6.3 典型造影劑
基本上具有光熱轉換特性的材料都可以實現光熱成像。比如,金納米顆粒(金納米棒,金納米球,金納米星等等),石墨烯以及衍生物,聚吡咯等有機物。
拉曼成像(Raman imaging,RI)
7.1 成像原理
拉曼成像技術是新一代快速、高精度、面掃描激光拉曼技術,它將共聚焦顯微鏡技術與激光拉曼光譜技術完美結合,作為第三代Raman技術,拉曼光譜成像上的每一個像元,都對應於一條完整的拉曼光譜,這些數百、數千甚至數百萬條光譜綜合在一起,就產生了一幅反映材料的成分和結構的偽彩圖像。
成像媒介:拉曼散射光
常用儀器:激光共聚焦顯微拉曼光譜成像系統
C12-單壁碳納米管SWNT-抗體Her2與BT474細胞共孵育後的共聚焦拉曼光譜圖像(左)(中間的是光學圖像,右側的是重疊圖像)[15]。
7.2 優缺點
優點:分辨率高,掃描速度快,可避免組織自發熒光問題,可定性定量定位分析,可提供樣品的化學成分、分子結構、結晶度和應變應力等重要的生化信息
缺點:受光學成像穿透深度的限制,拉曼成像方法主要適用於活體淺表以及離體組織檢測;數據採集以及處理時間較長
7.3 典型造影劑
具有共振拉曼散射特性的材料:碳基納米材料,比如單壁碳納米管,石墨烯;貴金屬納米顆粒,比如金納米顆粒
超聲成像(Ultrasound imaging,USI)
8.1 成像原理
超聲成像是利用超聲聲束掃描人體,通過對反射信號的接收、處理,以獲得體內器官的圖象。不同組織器官的反射規律不同。陣列聲場延時疊加成像是超聲成像中最傳統,最簡單的,也是目前實際當中應用最為廣泛的成像方式。在這種方式中,通過對陣列的各個單元引入不同的延時,而後合成為一聚焦波束,以實現對聲場各點的成像。
成像媒介:超聲波
常用儀器:超聲成像儀,最常用的為B超
圖7 手工製作的瓊脂凝膠體模用於體外US成像。在37℃的鹽水中Gas-NPs的時間依賴性體外US圖像。通過從幻象信號中減去水強度來對US圖像進行歸一化處理[16]。
圖8 Gas-NPs的長期和持續的體內US腫瘤成像能力[16]。
8.2 優缺點
優點:價廉,簡便,無電離輻射性,成像速度快,對軟組織結構分辨率高,對比性強,實時成像,無痛苦,易被多數患者使用。
缺點:受氣體與骨骼的阻礙,不適合於含氣臟器的檢查;診斷準確性影響因素較多,受操作者經驗技巧影響,比如超聲偽像是聲像圖畸變,易導致誤診。
8.3 典型造影劑
超聲造影劑是一種含有直徑為幾微米氣泡的液體。利用含有氣泡的液體對超聲波有強散射的特性,臨床將超聲造影劑注射到人體血管中用以增強血流的超聲多普勒信號和提高超聲圖像的清晰度和分辨率。
第一代超聲造影劑微泡內含空氣,包膜一般為白蛋白或半乳糖等聚合體。
第二代超聲造影劑為包裹高密度惰性氣體(不易溶於水或血液)為主的外膜薄而柔軟的氣泡,比如全氟丙烷脂質微泡。
光聲成像(Photoacoustic imaging,PAI)
9.1 典型造影劑
PAI是近年來發展起來的一種非入侵式和非電離式的新型生物醫學成像方法。當脈衝激光照射到生物組織中時,組織的光吸收域將產生超聲信號,我們稱這種由光激發產生的超聲信號為光聲信號。生物組織產生的光聲信號攜帶了組織的光吸收特徵信息,通過探測光聲信號能重建出組織中的光吸收分布圖像。
成像媒介:超聲波
常用儀器:光聲計算機斷層掃描和光聲顯微鏡
不同造影劑對小鼠腦PA成像的影響的比較[17]。
9.2 優缺點
優點:比純光學成像穿透更深(可實現70 mm的深層活體內組織成像),比傳統MRI以及PET成像的分辨率更高,對人體無害,非常安全,可應用於臨床。
缺點:PAI結合了超聲成像和光學成像各自的優點,成為近年來最有希望發展的一種成像技術,不過也有它需要克服的難題,比如,在光聲顯微成像方面,如何提高光聲顯微成像的速度使其更加適應臨床診斷以及檢測等等。
9.3 典型造影劑
金屬基納米材料,碳基納米材料,過渡金屬硫屬元素化物/基於MXene的納米材料,有機小分子,半導體聚合物納米粒子[18]。
10.總結與展望
10.1 多模態成像——優化組合,揚長避短
以上八種成像技術各有各的優點以及不足之處,因此為了更好地提高診斷效率,多模態成像成為大勢所趨——正所謂八仙過海,各顯神通,團結就是力量。當然也不是說八種成像技術同時運用,一方面,幾乎不大可能實現,另一方面,也沒那必要。一般來說,三四種成像技術的結合基本上就可以滿足需求。比如,PET/CT/MRI三模態成像,一方面,PET圖像以高靈敏度提供關於疾病的功能信息。另一方面,CT和MRI提供解剖信息的高分辨率圖像。因此,這些不同成像模式的組合可以同時執行高靈敏度和高分辨率,並提供關於目標疾病的更詳細的解剖學或生物學信息。儘管預期這些組合能夠比單一成像技術提供更準確和詳細的信息,但是多模態成像的合理模態的合理選擇非常重要。在多模態成像組合的選擇和設計過程中,研究人員應合理地禁止優勢的重疊,而應補償每種模態的弱點,以達到最大化的協同效應。這便是具有高靈敏度(PET,FI等)的成像模態經常與具有高空間分辨率(MRI,CT等)的其他成像模態組合的原因。
10.2 不同造影劑的選擇與組合
儘管不同的成像技術相互補償,但仍然存在對每種模態的不同靈敏度的擔憂。例如,PET或NIRF試劑可以以極低濃度使用,而MRI和CT試劑則需要相對高的濃度。因此,有必要更多地關注組合成像劑到納米顆粒中的量。
10.3 成像儀器的改善與優化
大部分情況下,不同成像模式是需要不同成像儀器來實現的。當需要對樣品進行多種測量時,就得移動樣品到多台設備上測量,這樣不僅會耗時耗力,還會影響測量準確度。因此,成像儀器的改善與進步也是我們需要努力的一方面,有望通過提供少量探針的精細圖像來幫助解決這些問題。比如,拉曼-熒光光譜測量系統,一台設備即可實現拉曼成像,熒光成像,光電流成像,熒光壽命成像等多種功能。無需移動樣品到多台設備上測量,可以對樣品同一位置進行拉曼,熒光,熒光壽命,光電流多種測量,消除樣品移動造成的位置誤差。
綜上,八種成像技術,你最青睞哪一種,或者認為哪幾種是最佳搭檔?歡迎在留言區討論,希望與各位老師同學互相指教,共同進步。作者水平有限,如有不妥,請批評指正。